La Food and Drug Administration (FDA) américaine a approuvé une thérapie révolutionnaire d’édition génétique pour traiter la drépanocytose.
La décision a été prise par la FDA le 9 décembre. Les deux thérapies approuvées s'appellent Casgevy, qui est basée sur la technologie d'édition génétique CRISPR, lauréate du prix Nobel, et Lyfgenia, qui utilise un virus inoffensif pour modifier les gènes.
Casgevy est produit par deux sociétés, Vertex Pharmaceuticals (États-Unis) et CRISPR Therapeutics (Suisse). Le médicament agit pour réparer les gènes défectueux dans les cellules souches des patients âgés de 12 ans et plus atteints de drépanocytose et de thalassémie.
Les deux maladies proviennent de défauts dans le gène qui transporte l’hémoglobine. En règle générale, les traitements de thérapie génique coûtent des millions de dollars, hors de portée de nombreux patients. Le fabricant Vertex Pharmaceuticals s'efforce de maintenir le prix aussi bas que possible.
L'approbation de la FDA intervient après que l'Agence de réglementation des médicaments et des produits de santé du Royaume-Uni (MHRA) a approuvé la thérapie en novembre.
Pendant ce temps, Lyfgenia utilise le transfert de gènes pour modifier les gènes. Il modifie les cellules souches sanguines du patient pour produire de l’hémoglobine à partir d’une source génétique. Selon la FDA, lorsqu’elle est ajoutée aux globules rouges, l’hémoglobine réduit le risque de drépanocytose.
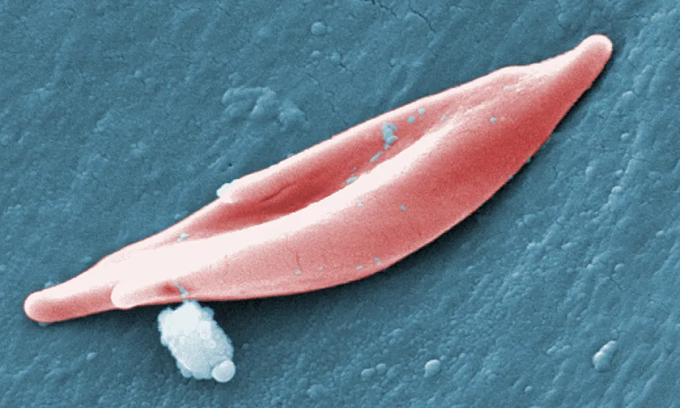
Un globule rouge en forme de faucille. Photo : CDC
« Ces traitements représentent des avancées majeures dans le domaine de la thérapie génique pour les patients atteints de drépanocytose. Leur potentiel de changement de vie est énorme », a déclaré Peter Marks, directeur du Centre d'évaluation et de recherche sur les produits biologiques de la FDA.
La thérapie génique rend le traitement plus ciblé et plus efficace, en particulier pour les personnes atteintes de maladies rares qui ont des options de traitement limitées, selon le Dr Nicole Verdun de la FDA.
La FDA est « ravie de faire progresser ce domaine », a-t-elle ajouté, car elle aide les personnes dont la vie est gravement perturbée par la maladie.
L'approbation de l'agence signifie qu'environ 16 000 personnes atteintes de drépanocytose auront une autre option de traitement potentielle. La maladie touche environ 100 000 Américains et plus de 7,7 millions de personnes dans le monde, principalement des personnes d’origine africaine et caribéenne. Il s’agit d’une maladie sanguine rare, invalidante et potentiellement mortelle. Les besoins de traitement de nombreuses personnes restent non satisfaits.
Les patients atteints de drépanocytose ont des globules sanguins allongés en forme de faucille au lieu de la forme ronde et concave typique. Les cellules déformées se coincent dans les vaisseaux sanguins, bloquant l’apport d’oxygène, provoquant chez les patients de fortes douleurs, voire un accident vasculaire cérébral et des lésions organiques.
Thuc Linh (Selon AFP, AP )
Lien source


![[Photo] Le Premier ministre Pham Minh Chinh préside une réunion pour examiner les préparatifs des négociations commerciales avec les États-Unis](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/6/1edc3a9bab5e48db95318758f019b99b)

![[Photo] Le Premier ministre Pham Minh Chinh reçoit M. Tomas Heidar, juge en chef du Tribunal international du droit de la mer (TIDM)](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/6/58ba7a6773444e17bd987187397e4a1b)
![[Photo] Le Premier ministre Pham Minh Chinh préside la réunion ordinaire du gouvernement en avril 2025](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/6/48eb0c5318914cc49ff858e81c924e65)
![[Photo] Des lanternes scintillantes pour célébrer Vesak 2025](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/7/a6c8ff3bef964a2f90c6fab80ae197c3)






















































































Comment (0)