Le Pakistan enquête sur deux distributeurs du médicament anticancéreux Avastin de Roche après que 12 patients diabétiques ayant reçu des injections du médicament soient devenus aveugles. Avastin est également autorisé au Vietnam.
Au Vietnam, au 27 septembre, l'Administration des médicaments du Vietnam (ministère de la Santé) n'a reçu aucun rapport faisant état d'effets indésirables d'Avastin liés à la perte de vision des patients après avoir utilisé Avastin.
L'Administration des médicaments du Vietnam a reçu un rapport du bureau de représentation de F. Hoffmann La Roche Ltd. à ce sujet.
Plus précisément, au Pakistan, environ 12 patients ont perdu la vue après avoir utilisé des injections fournies par le fournisseur illégal Genius Pharmaceutical Service. Le médicament est étiqueté « Inj. Avastin 1,25 mg/0,05 ml », ce qui donne l’impression trompeuse qu’il s’agit d’un produit Roche.
L'Avastin de Roche n'est pas approuvé pour une utilisation dans aucune indication ophtalmique. Genius Pharmaceutical Service a fourni/dilué/reconditionné le médicament à un dosage de 1,25 mg/0,5 ml dans des conditions insalubres et non approuvées.
Les autorités pakistanaises enquêtent pour déterminer la cause de l’infection. Les causes peuvent inclure une stérilisation inadéquate, des flacons contaminés, des seringues non stériles et des écarts par rapport aux procédures opérationnelles standard lors de la distribution des médicaments.
Dans le même temps, le gouvernement pakistanais a demandé le rappel de 3 lots d'Avastin 100 mg/ml (H352B11, B7266B07, B7266B20) de Roche et de tous les médicaments fournis par Genius Pharmaceutical Service.
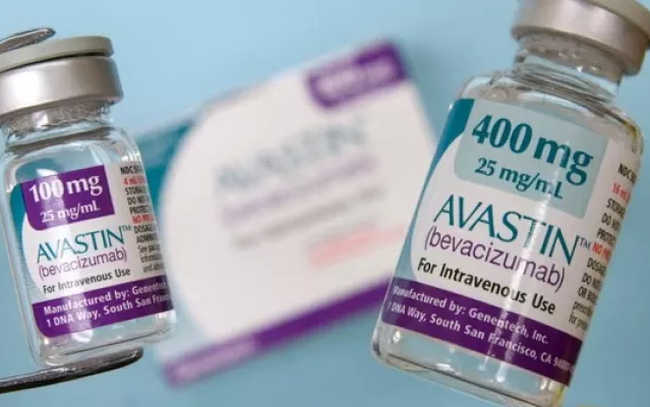
(Illustration : 24 News HD).
Au Vietnam, le médicament Avastin (principe actif Bevacizumab) a obtenu 4 certificats d'enregistrement de circulation, tous toujours valables. Inclure:
Bevacizumab 100 mg/4 ml (boîte de 1 flacon x 4 ml ; numéro d'enregistrement : 400410250123 (QLSP-1118- 18) ; fabricant : Roche Diagnostics GmbH, Allemagne).
Bevacizumab 400 mg/16 ml (boîte de 1 flacon x 16 ml : numéro d'enregistrement : 400410250223 (QLSP-1119- 18) ; fabricant : Roche Diagnostics GmbH, Allemagne).
Bevacizumab 100 mg/4 ml (boîte de 1 flacon x 16 ml ; numéro d'enregistrement : QLSP-1010-17 ; fabricant : F. Hoffmann-La Roche Ltd., Suisse).
Bevacizumab 400 mg/16 ml (boîte de 1 flacon x 16 ml ; numéro d'enregistrement : QLSP-1011-17 ; fabricant : F. Hoffmann-La Roche Ltd., Suisse).
L'Avastin est autorisé à la circulation au Vietnam pour traiter certains cancers. Y compris le cancer colorectal métastatique, le cancer du poumon non à petites cellules avancé, métastatique ou récurrent, le carcinome rénal avancé et/ou métastatique, le glioblastome/gliome malin (stade IV de l’OMS) ; cancer épithélial de l'ovaire, des trompes de Fallope et du péritoine primitif.
En plus des avertissements généraux, la notice d'emballage approuvée par la FDA comprend un avertissement indiquant « ne pas utiliser dans un usage intravitréen ».
Plus précisément, le médicament peut provoquer des troubles visuels, et des cas individuels et des groupes d'événements indésirables oculaires graves ont été signalés après une injection intravitréenne, une voie d'administration non approuvée avec des mélanges d'Avastin provenant de flacons destinés à la perfusion intraveineuse chez des patients atteints de cancer.
Ces réactions comprennent l’infection intraoculaire, l’endophtalmie, l’uvéite, le décollement de la rétine, la déchirure de l’épithélium pigmentaire rétinien, le glaucome, l’hémorragie intraoculaire… Certains de ces événements ont entraîné divers degrés de perte du champ visuel, y compris la cécité permanente .
Source



![[Photo] Des jeunes font la queue pour recevoir le supplément spécial commémorant le 50e anniversaire de la libération du Sud du journal Nhan Dan](https://vstatic.vietnam.vn/vietnam/resource/IMAGE/2025/4/26/9e7e624ae81643eba5f3cdc232cd07a5)
![[Photo] Le Premier ministre Pham Minh Chinh préside la réunion du Comité de pilotage des projets clés et des projets ferroviaires](https://vstatic.vietnam.vn/vietnam/resource/IMAGE/2025/4/26/b9534596258a40a29ebd8edcdbd666ab)

![[Photo] L'affection des habitants de Hô-Chi-Minh-Ville pour le défilé](https://vstatic.vietnam.vn/vietnam/resource/IMAGE/2025/4/26/7fcb6bcae98e46fba1ca063dc570e7e5)
![[Photo] La joie des lecteurs à la réception du supplément commémorant le 50e anniversaire de la libération du Sud et de la réunification nationale du journal Nhan Dan](https://vstatic.vietnam.vn/vietnam/resource/IMAGE/2025/4/26/283e56713da94988bf608393c0165723)

























































































Comment (0)