Selon le vice-ministre de la Santé Do Xuan Tuyen, le ministère de la Santé révise et modifie la loi sur la pharmacie pour la soumettre à l'Assemblée nationale pour examen dans le but d'attirer les investissements dans la recherche et le développement de technologies, la production ou le transfert de technologies pour produire des substances pharmaceutiques, de nouveaux médicaments, des médicaments de marque originaux, des médicaments rares, des premiers médicaments génériques, des médicaments de haute technologie, des vaccins et des produits biologiques provenant de sociétés pharmaceutiques étrangères au Vietnam, en développant de manière proactive une production nationale durable tout en promouvant les exportations pharmaceutiques vers les marchés avancés.

Le ministère de la Santé propose des politiques pour attirer les investissements, développer de nouveaux médicaments et des médicaments rares
Fournissant des informations spécifiques sur des propositions importantes affectant l'attraction des investissements, la production et le commerce pharmaceutiques ainsi que les opportunités d'accès à de nouveaux médicaments, un représentant du Département de l'administration des médicaments a déclaré qu'en ce qui concerne les procédures administratives, le projet de loi sur la pharmacie contient les propositions suivantes : simplification du dossier de renouvellement, de modification et de complément des certificats d'enregistrement de circulation des médicaments et des ingrédients pharmaceutiques ; Réglementer les cas de prolongation, de modification et de complément des certificats d'enregistrement de circulation sans avoir à passer par le Conseil consultatif d'enregistrement de circulation des médicaments ou à attendre l'approbation du ministère de la Santé pour simplifier les procédures administratives.
Le projet propose également de réduire le délai de traitement des dossiers de modification, qui prévoit que l’annonce ne doit être faite que de 3 mois à 15 jours ouvrables ; Réduire la période d’enregistrement pour la circulation de 12 mois à 9 mois en cas de reconnaissance et de référence ; et pas plus de 10 jours ouvrables pour le dossier d'enregistrement pour la circulation de nouveaux médicaments avec des indications d'utilisation dans la prévention et le traitement des maladies du groupe A qui ont été déclarées épidémiques et ont été autorisés à la circulation ou autorisés à l'utilisation dans les cas d'urgence ou autorisés à la circulation et à l'utilisation conditionnelle par l'une des agences de gestion stricte des médicaments annoncées par l'Organisation mondiale de la santé.
Les propositions ci-dessus visent à accélérer le processus d’autorisation de mise sur le marché, garantissant ainsi un accès rapide aux médicaments pour la population.
Sécurité pharmaceutique, réponse épidémique complexe
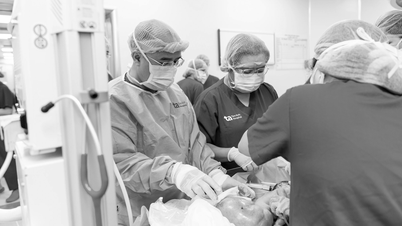
Après la pandémie de Covid-19, les pays ont compris que les vaccins jouaient un rôle important dans la prévention des maladies. Le directeur du département des sciences, de la technologie et de la formation du ministère de la Santé, Nguyen Ngo Quang, a déclaré que les sociétés pharmaceutiques nationales fournissent 11/12 vaccins pour une vaccination élargie. Les ressources humaines et les équipements nationaux permettent la réception et le transfert de la nouvelle production de vaccins à l’avenir.

La réduction des procédures d’autorisation tout en garantissant la sécurité et l’efficacité contribue à accroître l’accès aux nouveaux médicaments et vaccins.
Selon le Département des sciences, de la technologie et de la formation, en plus d'encourager le développement de la technologie des vaccins, les procédures de recherche clinique et d'autorisation de nouveaux vaccins sont menées avec des procédures simplifiées mais en garantissant toujours le premier principe, qui est : la sécurité et l'efficacité pour les utilisateurs.
Les représentants de certaines sociétés pharmaceutiques ont déclaré que le projet de loi sur la pharmacie reçoit actuellement de l'attention, car cette politique constitue la base sur laquelle les sociétés peuvent élaborer des stratégies d'investissement, de transfert et de développement de produits au Vietnam.
Fort de ses atouts dans les produits pharmaceutiques pour le traitement du cancer, des maladies rares et des vaccins, le directeur général de l'Asie du Sud-Est et de l'Inde de Takeda Company (Japon) a affirmé qu'il valorisait toujours la valeur des partenariats dans la construction d'un système de santé durable ; améliorer l’accès des patients à des méthodes de prévention et de traitement sûres et efficaces, y compris les vaccins.
Concernant l'étape importante dans la prévention des maladies lorsque le ministère de la Santé a approuvé le vaccin contre la dengue de Takeda en mai dernier, dans le contexte de l'augmentation de la dengue au Vietnam, le représentant de Takeda a affirmé : « Nous continuerons à coopérer avec les agences de santé, les universités, les instituts de recherche, les partenaires et les centres de vaccination publics et de service, et à fournir des programmes de formation aux professionnels de la santé sur les pratiques de vaccination sûres. »
Aucune interruption de l'approvisionnement en médicaments
Concernant les propositions du projet de loi sur la pharmacie, le représentant du groupe pharmaceutique au Vietnam a déclaré qu'ils soutenaient pleinement les nouveaux points positifs, en particulier les politiques : accélérer l'accès aux nouveaux médicaments, vaccins et produits biologiques ; Simplifier les procédures de renouvellement d’enregistrement afin de supprimer les charges administratives actuelles et d’éviter le risque de pénurie de médicaments comme cela s’est produit auparavant ; Des politiques d’incitation spéciales pour développer l’industrie pharmaceutique, telles que l’octroi d’incitations pour les activités de traitement, le transfert de technologie de nouveaux médicaments, les médicaments inventés ainsi que les activités de recherche et développement.
Dans le même temps, les représentants du groupe pharmaceutique s’attendent également à ce que la loi pharmaceutique soit adoptée par l’Assemblée nationale en 2024 ; processus de mise en œuvre fluide et pratique lors de la mise en œuvre de nouvelles réglementations sur l'extension de l'enregistrement des médicaments et en espérant pouvoir appliquer cette nouvelle réglementation aux demandes de renouvellement soumises, afin de garantir la validité continue à partir du 1er janvier 2025 et d'éviter les ruptures d'approvisionnement.
Le Vietnam vise à ce que l'industrie pharmaceutique contribue à hauteur de plus de 20 milliards de dollars au PIB d'ici 2045. Le projet de loi sur la pharmacie propose des politiques visant à attirer les investissements dans la recherche et le développement de technologies, la production de substances pharmaceutiques, de nouveaux médicaments et de vaccins.
Source : https://thanhnien.vn/giam-thoi-gian-tham-dinh-ho-so-tang-co-hoi-tiep-can-thuoc-vac-xin-moi-185241003101908887.htm


![[Photo] Gros plan du pont Tang Long, ville de Thu Duc, après réparation des ornières](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/19/086736d9d11f43198f5bd8d78df9bd41)
![[Photo] Panorama de la cérémonie d'ouverture du 43e Championnat national de tennis de table du journal Nhan Dan](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/19/5e22950340b941309280448198bcf1d9)
![[Photo] Le président Luong Cuong présente l'insigne de 40 ans d'adhésion au Parti au chef du cabinet du président Le Khanh Hai](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/19/a22bc55dd7bf4a2ab7e3958d32282c15)
![[Photo] Le secrétaire général To Lam participe à la conférence pour passer en revue les 10 années de mise en œuvre de la directive n° 05 du Politburo et évaluer les résultats de la mise en œuvre du règlement n° 09 du Comité central du Parti pour la sécurité publique.](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/19/2f44458c655a4403acd7929dbbfa5039)






























![[Photo] Le Premier ministre Pham Minh Chinh inspecte l'avancement du projet du Centre national des expositions et des foires](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/19/35189ac8807140d897ad2b7d2583fbae)





















































![[VIDÉO] - Valoriser les produits OCOP de Quang Nam grâce aux relations commerciales](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/5/17/5be5b5fff1f14914986fad159097a677)





Comment (0)