De los casi 320 medicamentos, vacunas y productos biológicos médicos recientemente concedidos o cuyos registros de circulación se han extendido en esta ocasión, 2/3 son medicamentos, vacunas y productos biológicos extranjeros recientemente concedidos; El número restante es para renovación de registro.

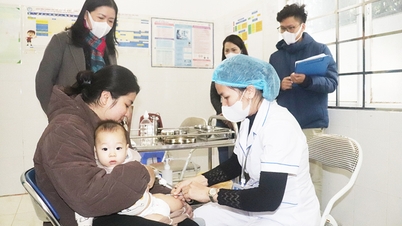
La Administración de Medicamentos de Vietnam, dependiente del Ministerio de Salud , informó que acaba de emitir certificados de registro de circulación nuevos y ampliados para casi 320 medicamentos, vacunas y productos biológicos médicos extranjeros por un período de 3 a 5 años.
De los casi 320 medicamentos, vacunas y productos biológicos médicos extranjeros cuyos certificados de registro de circulación fueron otorgados o extendidos esta vez, 2/3 de los medicamentos, vacunas y productos biológicos extranjeros fueron otorgados recientemente; El número restante es para renovación de registro. De los cuales, 171 medicamentos extranjeros obtuvieron nuevos certificados de registro de circulación en Vietnam, y 164 medicamentos extranjeros obtuvieron nuevos certificados de registro en un plazo de 5 años; 7 nuevos medicamentos obtendrán certificados de registro de circulación en el plazo de 3 años. Hay 71 medicamentos extranjeros, de los cuales 37 tienen una licencia nueva por 5 años y 3 tienen una licencia nueva por 3 años; 26 medicamentos extranjeros prorrogados por 5 años, 5 medicamentos extranjeros prorrogados por 3 años; 69 vacunas y productos biológicos médicos tienen su validez extendida por un periodo de 3 a 5 años.
La Administración de Medicamentos de Vietnam exige que los establecimientos de fabricación y registro de medicamentos, vacunas y productos biológicos sean responsables de fabricar y suministrar medicamentos a Vietnam de conformidad con los registros y documentos registrados en el Ministerio de Salud y deben imprimir o colocar el número de registro emitido por el Ministerio de Salud en la etiqueta del medicamento.
Además, cumplir plenamente con las leyes y regulaciones vietnamitas del Ministerio de Salud sobre producción, importación y circulación de medicamentos en Vietnam. Si se produce algún cambio en el proceso de circulación de medicamentos en el país de origen y en Vietnam, debe informarse inmediatamente a la Administración de Medicamentos.
La Administración de Medicamentos de Vietnam también requiere que los establecimientos de fabricación y registro de medicamentos actualicen los estándares de calidad de los medicamentos de acuerdo con las disposiciones de la Circular No. 11/2018/TT-BYT del 4 de mayo de 2018 del Ministro de Salud que regula la calidad de los medicamentos e ingredientes farmacéuticos, Circular No. 03/2020/TT-BYT del 22 de enero de 2020 del Ministro de Salud que modifica y complementa una serie de artículos de la Circular 11/2018/TT-BYT que regula la calidad de los medicamentos e ingredientes farmacéuticos.
Actualizar las etiquetas de los medicamentos y las instrucciones de los medicamentos de acuerdo con lo dispuesto en la Circular 01/2018/TT-BYT del 18 de enero de 2018 del Ministro de Salud que regula el etiquetado de los medicamentos, los ingredientes de los medicamentos y las instrucciones de los medicamentos en forma de cambio y complementación del certificado de registro de circulación de medicamentos prescrito en la Circular 08/2022/TT-BYT del 5 de septiembre de 2022 del Ministro de Salud para los medicamentos que no han actualizado el contenido de las etiquetas de los medicamentos y las instrucciones de los medicamentos de acuerdo con lo dispuesto en la Circular 01/2018/TT-BYT del 18 de enero de 2018 del Ministro de Salud.
Los establecimientos de registro de medicamentos deben garantizar que las condiciones de funcionamiento se mantengan durante el período de validez del certificado de registro de circulación de medicamentos e ingredientes de medicamentos. En caso de que la instalación de registro ya no cumpla con las condiciones de funcionamiento, deberá ser responsable de cambiar la instalación de registro de acuerdo con las disposiciones de la Circular No. 08/2022/TT-BYT dentro de los 30 días a partir de la fecha en que la instalación de registro ya no cumpla con las condiciones de funcionamiento.
Los establecimientos de registro de medicamentos deben informar al Ministerio de Salud (Departamento de Administración de Medicamentos) sobre el estado actualizado del cumplimiento de las Buenas Prácticas de Manufactura de los establecimientos fabricantes de medicamentos e ingredientes de medicamentos. En caso de que a una instalación de fabricación se le revoque su licencia de fabricación o no cumpla con las Buenas Prácticas de Fabricación para medicamentos e ingredientes farmacéuticos en el país de origen, la instalación debe presentar un informe dentro de los 15 días a partir de la fecha de notificación por parte de la agencia de gestión competente del país de origen según lo prescrito en el Punto d, Cláusula 1, Artículo 100 del Decreto No. 54/2017/ND-CP del 8 de mayo de 2017 del Gobierno que detalla una serie de artículos y medidas para implementar la Ley de Farmacia.
Los centros de registro de medicamentos se coordinan con los centros de tratamiento para cumplir con las regulaciones actuales sobre medicamentos recetados, monitorear la seguridad, la eficacia y los efectos adversos de los medicamentos en los vietnamitas, y sintetizar e informar de acuerdo con las regulaciones del Artículo 5 de la Circular No. 08/2022/TT-BYT para los medicamentos del Apéndice II emitidos con la Decisión.
Anteriormente, la Administración de Medicamentos de Vietnam también emitió decisiones para otorgar nuevas licencias y extender cerca de 500 medicamentos e ingredientes farmacéuticos producidos a nivel nacional e internacional, y medicamentos con bioequivalencia comprobada.
[anuncio_2]
Fuente: https://www.vietnamplus.vn/gan-320-san-pham-thuoc-vaccine-va-sinh-pham-y-te-duoc-cap-moi-gia-han-luu-hanh-post1000108.vnp





![[Foto] Líderes del Partido y del Estado asisten al programa artístico especial "Tú eres Ho Chi Minh"](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/18/6895913f94fd4c51aa4564ab14c3f250)
![[Foto] Muchos jóvenes hicieron fila pacientemente bajo el ardiente sol para recibir un suplemento especial del periódico Nhan Dan.](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/18/6f19d322f9364f0ebb6fbfe9377842d3)
![[Foto] Listos para las máximas competiciones de tenis de mesa vietnamita](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/18/9c547c497c5a4ade8f98c8e7d44f5a41)



























































































Kommentar (0)