اكتشف باحثون من قسم الكيمياء بجامعة أكسفورد (المملكة المتحدة) أن الجسيمات التي تحمل نفس الشحنة في محلول ما يمكن أن تنجذب إلى بعضها البعض من مسافة بعيدة، اعتمادًا على المذيب المستخدم وإشارة الشحنة. نُشرت هذه الدراسة في مجلة Nature Nanotechnology ، بحسب مجلة Newsweek .
قام الباحثون بمراقبة جسيمات السيليكا المشحونة سلبًا والمعلقة في المحلول ووجدوا أن الجسيمات في الواقع تنجذب إلى بعضها البعض، وتشكل مجموعات مرتبة في شكل سداسيات أثناء انجذابها إلى بعضها البعض.
في حين أن الجسيمات المشحونة سلبًا في المحلول تنجذب إلى بعضها البعض، فإن الجسيمات المشحونة إيجابيا لا تفعل ذلك. ويعتقد العلماء أن هذه الظاهرة تعود إلى قوة جاذبية فريدة من نوعها للمياه، وهي أقوى من القوة الكهروستاتيكية المعتادة، مما يسمح بتكوين هذه العناقيد. ومع ذلك، فإن قوة الجاذبية هذه ليس لها تأثير على الجسيمات المشحونة إيجابيا في الماء.
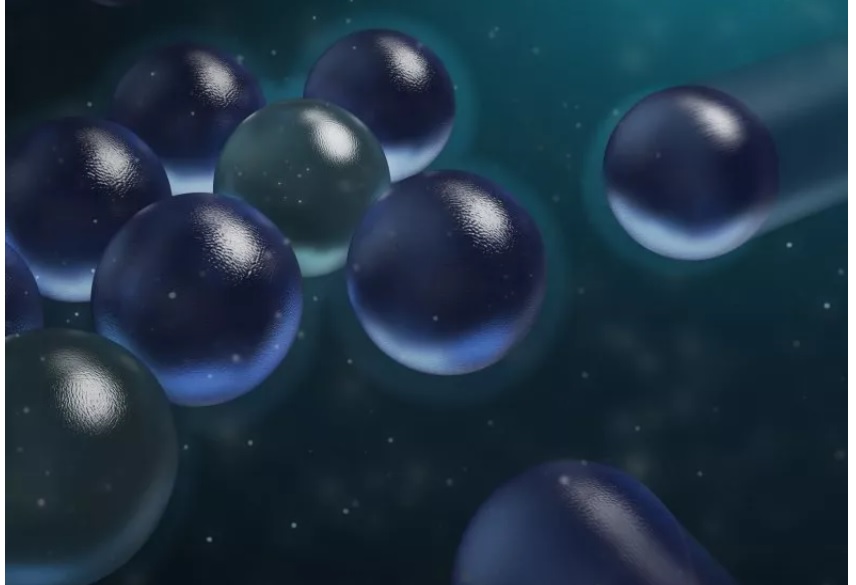
اكتشف العلماء أن جسيمات السيليكا المشحونة سلبًا في المحلول يمكنها في الواقع جذب بعضها البعض.
لقطة شاشة من نيوزويك
ووجد العلماء أيضًا أنهم قادرون على التحكم في تكوين مجموعات الجسيمات المشحونة سلبًا عن طريق تغيير الرقم الهيدروجيني. ومع ذلك، بغض النظر عن درجة الحموضة، فإن الجسيمات المشحونة إيجابيا لا تجتذب بعضها البعض.
وتساءل الفريق أيضًا طوال فترة البحث عما إذا كان التأثير على الجسيمات المشحونة إيجابيا قد يتغير مع تغيير المذيب. وعندما قاموا بتغيير المحلول إلى الكحول بدلا من الماء، لاحظوا أن جزيئات السيليكا المشحونة إيجابيا شكلت مجموعات مثل تلك الموجودة بالأعلى، في حين أن الجزيئات المشحونة سلباً لم تفعل ذلك.
وقالت مادهافي كريشنان، الأستاذة بجامعة أكسفورد والتي قادت البحث: "أنا فخورة حقًا بطلابي في الدراسات العليا والطلاب الجامعيين الذين عملوا معًا لتطوير هذا الاكتشاف الأساسي".
ويعتقد الباحثون أن أبحاثهم ستغير الطريقة التي يفكر بها العلماء في العمليات مثل كيفية استقرار الأدوية والمواد الكيميائية أو كيفية تطور بعض الأمراض. واكتشفوا أيضًا كيفية قياس خصائص الشحنة التي يولدها المذيب، وهو الأمر الذي كان يُعتقد سابقًا أنه مستحيل.
[إعلان 2]
رابط المصدر


![[صورة] رئيس الجمعية الوطنية تران ثانه مان يترأس اجتماع اللجنة الفرعية للوثائق في المؤتمر الوطني الأول للحزب](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/8/72b19a73d94a4affab411fd8c87f4f8d)
![[صورة] الأمين العام تو لام يبدأ زيارة رسمية إلى روسيا ويحضر الذكرى الثمانين للنصر على الفاشية](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/8/5d2566d7f67d4a1e9b88bc677831ec9d)
![[صورة] رئيس الوزراء فام مينه تشينه يلتقي مع المجلس الاستشاري للسياسات بشأن التنمية الاقتصادية الخاصة](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/8/387da60b85cc489ab2aed8442fc3b14a)
![[صورة] الرئيس لونغ كونغ يقدم قرار تعيين نائب رئيس مكتب الرئيس](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/8/501f8ee192f3476ab9f7579c57b423ad)
![[صورة] الأمين العام يختتم زيارته إلى أذربيجان ويتوجه إلى روسيا الاتحادية](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/8/7a135ad280314b66917ad278ce0e26fa)

























































![[صورة] رئيس الوزراء فام مينه تشينه يتحدث عبر الهاتف مع رئيس الوزراء السنغافوري لورانس وونغ](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/5/8/e2eab082d9bc4fc4a360b28fa0ab94de)






























تعليق (0)